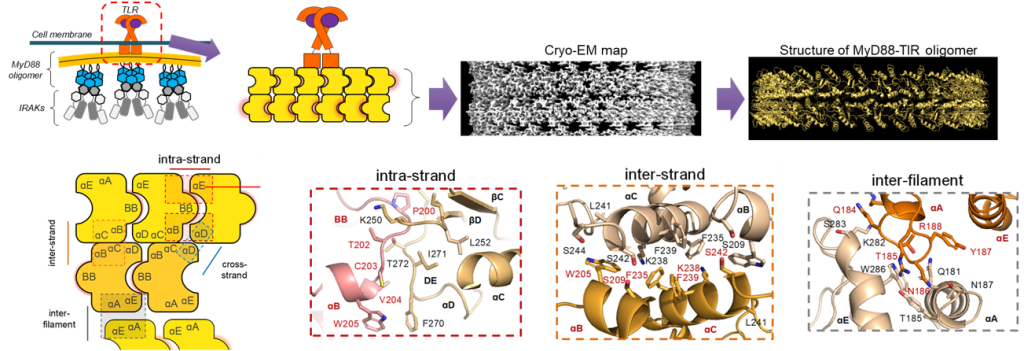
笠井君(現在・阪大生命機能研究科・研究員)が進めてきたMyD88の構造解析の論文をプレプリントサーバーで公開しました。
MyD88は、Toll様受容体(TLR)およびインターロイキン-1ファミリーのシグナル伝達で中心的な役割を果たすアダプタータンパク質です。MyD88は、膜受容体の活性化に伴い、細胞内で多量体を形成することで下流のキナーゼをリクルート・活性化することが知られています。しかし、受容体がMyD88の多量化を引き起こすメカニズムは未解明でした。本研究では、MyD88に含まれ、多量化の鍵となるTIR (Toll/IL-1 Receptor)ドメインについて解析しました。まず、クライオ電子顕微鏡を使ってMyD88-TIRが形成する多量体の構造を決定しました。その結果、下図のように個々のTIRドメインが直線状に連なって一本の鎖を形成し、さらに、二本の鎖が逆平行に重なっていることがわかりました。この構造から「なぜMyD88が多量化すると下流のキナーゼが活性化されるのか」という問題に答えることができました。
さらに、高速原子間力顕微鏡(High-Speed AFM)を使って、逆平行二重鎖の形成過程、および、受容体との相互作用を1分子レベルで観察することに成功しました。これらAFMから得られた分子ダイナミクス情報とクライオ電顕で得られた原子分解能の構造情報を統合することで、「受容体が活性化していない場合はMyD88の多量化が抑制され、受容体が活性化すると多量化が促進される」という制御を実現している分子機構が明らかになりました。そして、その制御の中心にMyD88の構造可塑性があることが明らかになりました。