自然免疫や炎症応答を制御するタンパク質の構造機能解析
免疫や炎症応答は、外部からの有害な侵入者(病原性のバクテリアやウイルス、活性酸素などの有害分子)や、遺伝子変異が蓄積し異常化した自分自身の細胞(癌)など、我々が日々曝されている様々な脅威から身を守るための防御システムです。 このシステムは、侵入者や異常な細胞を認識する受容体や、その情報を細胞内に伝える様々なエフェクター分子等による、極めて複雑な生体分子間相互作用によって成り立っています。 我々は、この防御システムを、構造生物学、生化学、分子生物学的手法を組み合わせて研究し、分子構造レベルで理解する事を目指しています。
自然免疫シグナルで働くタンパク質MyD88
免疫細胞の表面には、Toll-like receptor(TLR)と呼ばれる病原体の侵入を検知するセンサータンパク質が存在します。TLRは、病原性細菌やウイルス(の構成分子)に結合すると、その情報を細胞内へと伝えます。この「シグナル」は細胞内での様々な生化学反応を経て、最終的に核内へ届き、炎症などの生体防御応答に関わる様々なタンパク質の発現を誘導します。当研究室では、このTLR下流のシグナル伝達経路に関わる構造機能解析を進めています。
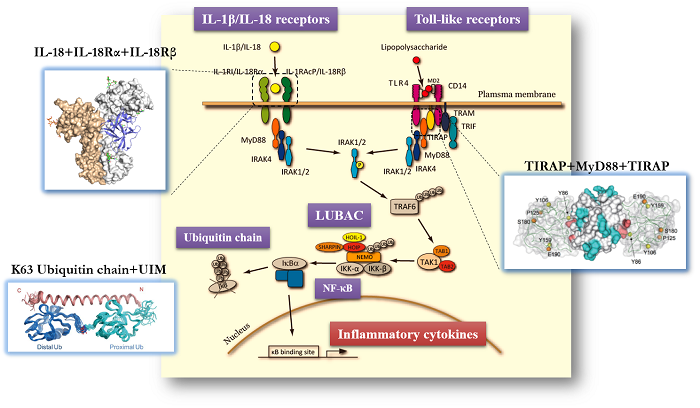
TLR下流のシグナルタンパク質の中でも、MyD88 (myeloid differentiation primary response 88)と呼ばれるタンパク質に注目しています。MyD88はTLRに直接結合し、これと細胞内のリン酸化酵素を結びつける役割を果たしているため、TLRが発したシグナルを細胞内に伝える過程で決定的に重要なタンパク質です。実際、MyD88の機能が損なわれると生体防御応答に異常が生じ、様々な疾患が引き起こされることが知られています。
私達は、 NMR分光法を用いてMyD88中のTIRドメインの立体構造を決定し、機能的に重要なアミノ酸残基を特定しました(PNAS 2009)。また、MyD88と下流のリン酸化酵素(IRAK4)の結合解析など(Mol Immunol 2014)、MyD88の分子機能を明らかにしました。また、高速AFM(原子間力顕微鏡)を使った1分子観察によってMyD88の構造変化の様子を捉えました。その結果、MyD88には機能を発揮できる「Extended型」と、機能が抑制された「Closed型」の2状態があることがわかりました (Chem Commun 2018) 。
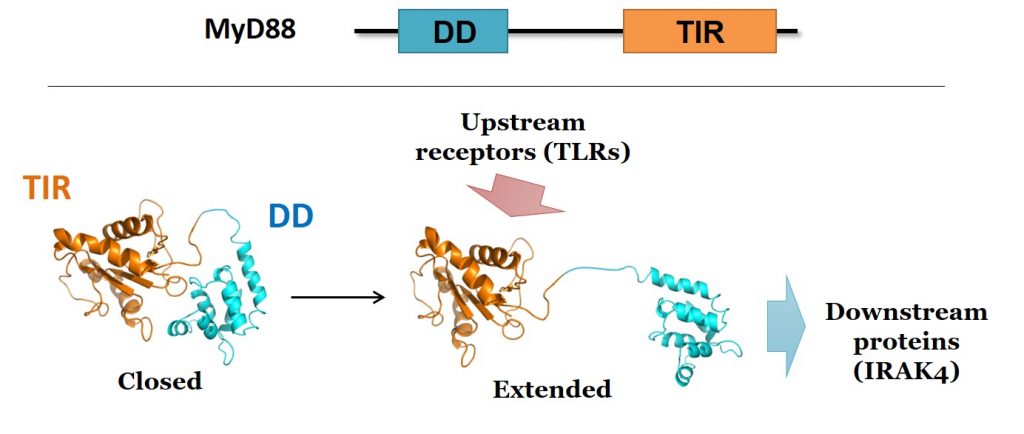
MyD88は上図のようにN末端のDeathドメイン(DD)とC末端側のTIRドメインからなります。Closed型では下流のタンパク質と結合できませんが、上流のTLRとTIRドメインが結合することでDDが自由になり(Extended型に変化)、DDを介して下流のタンパク質と結合できるようになります。これによってリン酸化酵素 IRAK4を始めとする各種のタンパク質が集積し、巨大なシグナル伝達複合体が形成される、というモデルを提唱しました。
TLRが活性化すると、MyD88が細胞内で多量体を形成し、それがIRAK4などのキナーゼのリクルートに重要なことが知られています。私達は、この多量体についてもクライオ電子顕微鏡によって構造決定に成功しました (bioRxiv 2024)。この構造と高速AFMによる分子動態の解析から多量体が形成される機構が明らかになりました。関連投稿。
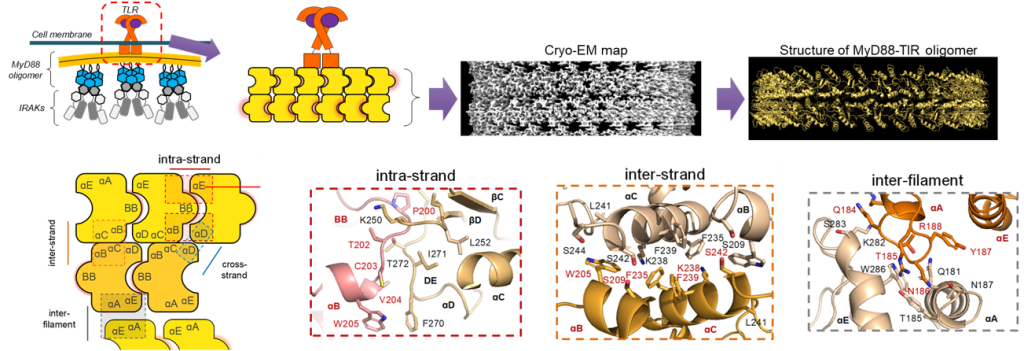
変異などによってMyD88の多量化が適切に調節されなくなると、免疫疾患やB細胞リンパ腫が引き起こされることが知られています。我々は、構造学的な知見をもとにして、MyD88関連疾患に対する治療薬開発のための基礎研究も進めています。
関連論文
- Kasai K et al. (2024) From Monomers to Oligomers: Structural Mechanism of Receptor-Triggered MyD88 Assembly in Innate Immune Signaling. bioRxiv, doi: https://doi.org/10.1101/2024.09.13.612588. Link
- Uno M, Watanabe-Nakayama T, Konno H, Akagi KI, Tsutsumi N, Fukao T, Shirakawa M, Ohnishi H, Tochio H. (2018) Intramolecular interaction suggests an autosuppression mechanism for the innate immune adaptor protein MyD88. Chem Commun, 54, 12318.
- Yamamoto T, Tsutsumi N, Tochio H, Ohnishi H, Kubota K, Kato Z, Shirakawa M, Kondo N. (2014) Functional assessment of the mutational effects of human IRAK4 and MyD88 genes. Mol Immunol, 58, 66.
- Ohnishi, H., Tochio, H., Kato, Z., Orii, K.E., Li, A.L., Kimura, T., Hiroaki, H., Kondo, N., and Shirakawa, M. (2009). Structural basis for the multiple interactions of the MyD88 TIR domain in TLR4 signaling. Proc Natil Acad Sci USA, 106, 10260-10265.
炎症性サイトカインIL-18と受容体の複合体の構造
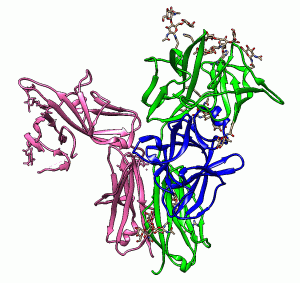
インターロイキン (IL)-1ファミリーのメンバーであるIL-18は強力に炎症を誘導するサイトカインで、生体防御にとって重要なタンパク質です。その一方で、IL-18の過剰な産生によって様々な炎症疾患やアレルギーが引き起こされることが報告されています。我々は、IL-18(青色) が細胞表面の受容体α(緑)とβ(桃)に認識され結合した構造を決定し、分子間の結合様式を詳細に調べました。これにより、IL-18が細胞を活性化する機構の一端が解明されました。この情報を利用することで、過剰なIL-18産生に起因する疾患の治療薬開発が促進されると期待されます。
関連論文
- Tsutsumi N, Yokota A, Kimura T, Kato Z, Fukao T, Shirakawa M, Ohnishi H, Tochio H. (2019) An innate interaction between IL-18 and the propeptide that inactivates its precursor form. Sci Rep, 9, 6160.
- Tsutsumi N, Kimura T, Arita K, Ariyoshi M, Ohnishi H, Yamamoto T, Zuo X, Maenaka K, Park EY, Kondo N, Shirakawa M, Tochio H, Kato Z. (2014) The structural basis for receptor recognition of human interleukin-18. Nat Commun, 5, 5340.
- Kimura T, Tsutsumi N, Arita K, Ariyoshi M, Ohnishi H, Kondo N, Shirakawa M, Kato Z, Tochio H. (2014) Purification, crystallization and preliminary X-ray crystallographic analysis of human IL-18 and its extracellular complexes. Acta Crystallogr F Struct Biol Commun, 70, 1351.
- Ohnishi, H., Tochio, H., Kato, Z., Kawamoto, N., Kimura, T., Kubota, K., Yamamoto, T., Funasaka, T., Nakano, H., Wong, R.W., Shirakawa, M., Kondo, N. (2012) TRAM is involved in IL-18 signaling and functions as a sorting adaptor for MyD88. PLoS One, 7, e38423.
